ANMAT clausuró otro laboratorio por una grave contaminación: "Puede ser potencialmente mortal"
Advierten que se trata de un riesgo grave para los pacientes. Pidieron recuperar los medicamentos que ya fueron distribuidos. ¿Qué encontraron en la inspección?
A fines de la semana pasada, la Administración Nacional de Alimentos, Medicamentos, y Tecnología Médica (ANMAT) informó que se detectaron irregularidades en un importante laboratorio, donde se fabrica suero destinado a distintos hospitales, clínicas y sanatorios. Se trataba de una segunda clausura tras el escándalo que se dató por el fentanilo contaminado que mató a 96 personas en Argentina. Ahora se suma un tercer laboratorio en el que se detectan graves irregularidades.
Según se reveló la semana pasada, en el Laboratorio Rivero se detectó “desvíos de calidad” en suero para pacientes internados, y aclaró que se trata de una empresa que tiene una historia de intimaciones y de deficiencias no corregidas.
En las últimas horas se conoció la decisión de la ANMAT sobre la clausura de un tercer laboratorio en el país, por el que se ordenó además el retiro de mercado de dos productos. Según precisó el organismo, se prohibió el uso y comercialización de dos soluciones por la "persistencia en las deficiencias y los reportes de desvíos de calidad" y por no cumplir con las Buenas Prácticas de Fabricación y Control.
Se trata de la firma RIGECIN LABS S.A, que fue clausurada debido a múltiples y persistentes incumplimientos de las Buenas Prácticas de Fabricación y Control.
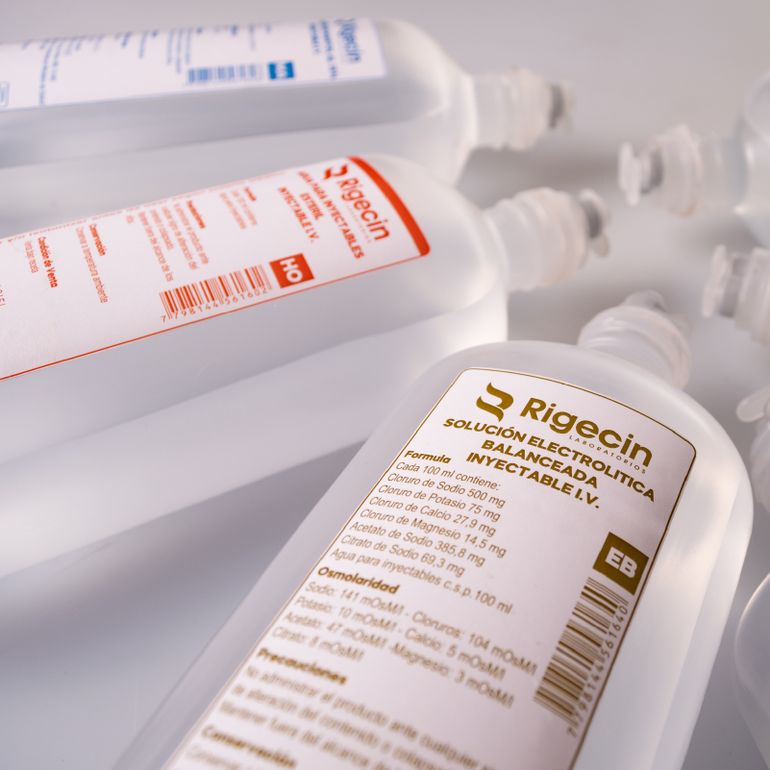
La medida fue publicada en la Disposición 6202/2025 de la ANMAT, donde se detalla que se recibieron reportes de desvíos de calidad en el producto SOLUCION ELECTROLITICA BALANCEADA RIGECIN, en su presentación de bolsa de 500 ml (lotes EB0440, EB0444, EB0405, EB0455 y EB0438).
Se trata de una solución de glucosa y electrolitos, que se usa para tratar la gran mayoría de los episodios de diarrea acuosa por gastroenteritis aguda.
Los informes indican la presencia de partículas en suspensión y presunta contaminación microbiológica en bolsas cerradas, que se re-suspendían al agitar (volvían a dispersarse por el líquido). Este incidente fue categorizado como crítico con prioridad de tratamiento alta, ya que representa un riesgo grave para la salud del paciente, especialmente para pacientes hospitalizados de alta vulnerabilidad, pudiendo ser potencialmente mortal.
Previo a ello, el Instituto Nacional de Medicamentos (INAME) había recibido un reporte de desvío de calidad sobre otro producto de la misma firma: SOLUCIÓN MOLAR DE BICARBONATO DE SODIO INYECTABLE RIGECIN (lote BI0091 S2). En este caso, el pH estaba fuera de especificación y el envase correspondía a un sistema abierto no conforme con la normativa vigente ni con los envases autorizados. Este incidente también fue categorizado como "CRITICA" con prioridad "ALTA".
Una grave denuncia y la decisión de la ANMAT
Tras esta situación se realizó una inspección en RIGECIN LABS S.A, donde se reveló incumplimientos a las Buenas Prácticas de Fabricación y Control (BPF), con deficiencias significativas clasificadas como CRÍTICAS y MAYORES que podrían comprometer la calidad, seguridad y eficacia de los productos.
A pesar de un Plan de Acciones Correctivas y Preventivas presentado por la firma, el mismo fue evaluado como insuficiente, ya que no se habían abordado la totalidad de las observaciones críticas y mayores. Inspecciones posteriores confirmaron que la mayoría de las acciones correctivas y preventivas para las deficiencias críticas y mayores no habían sido resueltas y las medidas propuestas eran inadecuadas.
La firma no presentó avances sobre las deficiencias registradas, es decir que la empresa no garantizaba que sus productos fueran adecuados para el uso, que cumplieran los requisitos de autorización y no representaran riesgos para los pacientes, ni que sus instalaciones y operaciones productivas fueran adecuadas para evitar errores o contaminación.
En este contexto, la ANMAT resolvió:
-Inhibir preventivamente las actividades productivas de RIGECIN LABS S.A.
-Prohibir el uso, comercialización y distribución en todo el territorio nacional de los lotes afectados de SOLUCION ELECTROLITICA BALANCEADA RIGECIN (EB0440, EB0444, EB0405, EB0455, EB0438) y SOLUCION MOLAR DE BICARBONATO DE SODIO INYECTABLE RIGECIN (BI0091 S2).
-Ordenar a RIGECIN LABS S.A. el recupero del mercado de todos los lotes mencionados de ambos productos.
-Instruir un sumario sanitario a la firma y a quien ejerza su dirección técnica por los incumplimientos a la normativa sanitaria.
Te puede interesar...